Mục lục
I, Cấu trúc, đồng đẳng đồng phân và danh pháp
1. Cấu trúc phân tử benzen
2. Đồng đẳng, đồng phân và danh pháp của benzen
III, Tính chất hóa học
1. Phản ứng thế
2. Phản ứng nitro hóa
3. Phản ứng oxi hóa
IV, Ứng dụng và điều chế
1.Ứng dụng
2. Điều chế
Cấu trúc, đồng đẳng đồng phân và danh pháp
1. Cấu trúc phân tử benzen:
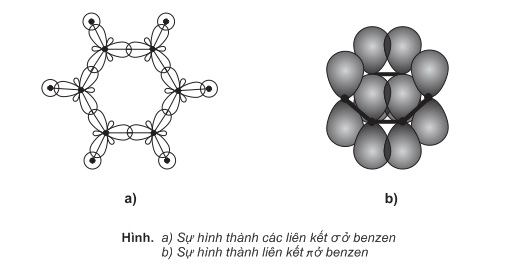
Mô hình phân tử benzen: có 2 mô hình phân tử benzen (mô hình rỗng và mô hình đặc)
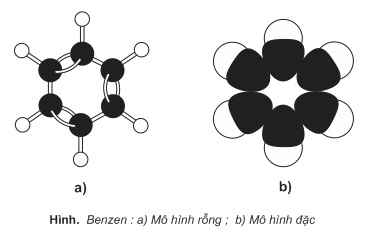 Sáu nguyên tử C trong phân tử benzen tạo thành một lục giác đều, cả 6 nguyên tử C và 6 nguyên tử H đều cùng nằm trong một mặt phẳng (mặt phẳng phân tử). Các góc liên kết đều bằng 120 độ.
Sáu nguyên tử C trong phân tử benzen tạo thành một lục giác đều, cả 6 nguyên tử C và 6 nguyên tử H đều cùng nằm trong một mặt phẳng (mặt phẳng phân tử). Các góc liên kết đều bằng 120 độ.
2. Đồng đẳng, đồng phân và danh pháp của benzen
Ta thu được các ankylbenzen khi thay các nguyên tử hidro trong phân tử benzen bằng các nhóm alkyl, ví dụ như sau:
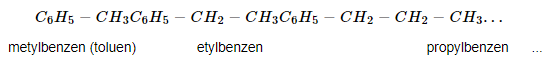
Các nakylbenzen họp thành đồng đẳng của benzen, công thức chung là:
![]()
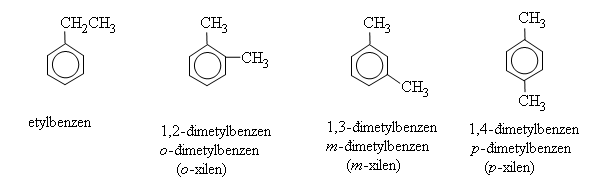
Tính chất vật lí
Benzen và ankylbenzen là những chất không màu, không tan trong nước nhưng tan nhiều trong dung môi hữu cơ, chính chúng cũng là dung môi hòa tan nhiều chất khác:
- Ví dụ như benzen hòa tan brom, iot, lưu huỳnh, cao su, chất béo,… Các aren đều là những chất có mùi.
- Ví dụ như benzen và toluen có mùi thơm nhẹ, nhưng có hại cho sức khỏe, nhất là benzen.
Tính chất hóa học
1. Phản ứng thế
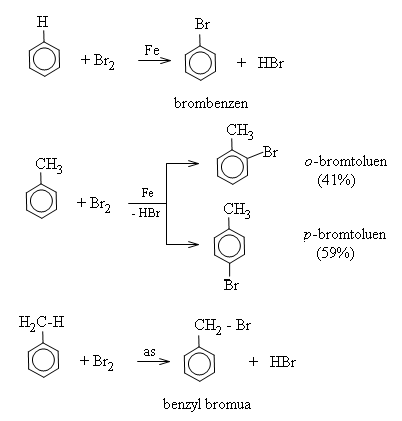 Phản ứng halogen hóa: Benzen tác dụng với brom (khi có bột sắt) để tạo thành brombenzen và khí hidro brommua.
Phản ứng halogen hóa: Benzen tác dụng với brom (khi có bột sắt) để tạo thành brombenzen và khí hidro brommua.
Hai đồng phân ortho và para được tạo thành do toluen phản ứng nhanh với hỗn hợp benzen.
Lưu ý: trong trường hợp không dùng sắt mà thay vào đó là điều kiện ánh sáng, brom sẽ thế cho hidro ở nhánh.
![]()
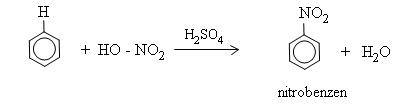
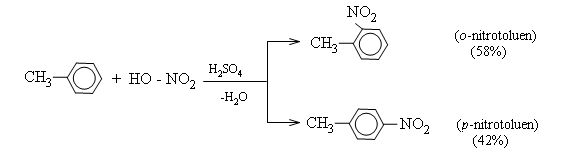
2. Phản ứng nitro hóa
Benzen tác dụng với hỗn hợp axit tạo thành nitrobenzen: ![]()
Toluen tham gia phản ứng nitro hóa dễ dàng hơn benzen:
2. Phản ứng cộng
Ankylbenzen và benzen không làm mất màu dung dịch brom như các hidrocacbon không no, trong điều kiện ánh sáng, benzen cộng với clo tạo thành ![]()
Trong điều kiện đung nóng có chất xúc tác Ni hoặc Pt, ankylbenzen và benzen cộng với hidro tạo thành xicloankan. Phương trình phản ứng:
![]()
3. Phản ứng oxi hóa
Benzen dễ tham gia phản ứng thế và khó tham gia phản ứng cộng, bền vững với các chất oxi hóa. Đây cũng là tính chất hóa học đặc trưng của các hidrocacbon thơm => được gọi là tính thơm.
Phương trình phản ứng của ankylbenzen khi đung nóng với các chất (benzen không phản ứng).
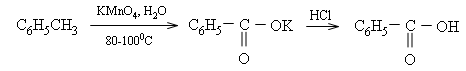
Các aren tạo ra nhiều muội than khi cháy trong không khí, tạo ta khí cacbonic, nước và nhiệt độ), ví dụ về phương trình phản ứng:
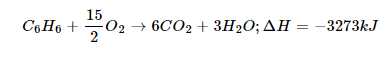
Ứng dụng và điều chế
- Ứng dụng
Benzen được ứng dụng rất nhiều trong công nghiệp hóa hữu cơ, được dùng nhiều để tổng hợp các monome trong quá trình sản xuât polime để làm chất dẻo, cao su, tơ sợi.
Không chỉ vậy, tử benzen người ra điều chế ra các nitrobenzen, anikin, phenol…dùng để tổng hợp phẩm nhuộn, dược phẩm, thuốc trừ dịch hạch.
Benzen, xilen, toluen còn được dùng làm dung môi, tuluen được dùng để sản xuất thuốc nổ NTN.
2. Điều chế
Benzen, toluen, xilen,… tách được bằng cách chưng cất dầu mỏ và nhựa than đá. Chúng còn được điều chế từ ankan, hoặc xicloankan:
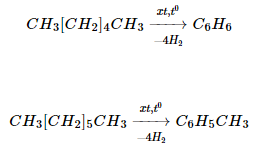
Entylbenzen được điều chế từ benzen và etilen: