Như vậy 2/3 thời gian học kỳ I của năm học 204-2025 đã trôi qua, còn vài tuần học nữa là diễn ra kỳ thi cuối kỳ. Để chuẩn bị cho việc ôn luyện của các em học sinh được thuận lợi nhất, HOCMAI đã tổng hợp lại toàn bộ kiến thức trọng tâm của học kỳ I môn Hóa học theo bộ sách Kết nối tri thức. Các em chú ý ôn luyện thật tốt để đạt được kết quả cao trong kỳ thi sắp tới!

Chương I: Cấu tạo nguyên tử
I. Thành phần Nguyên tử
1. Thành phần cấu tạo nguyên tử
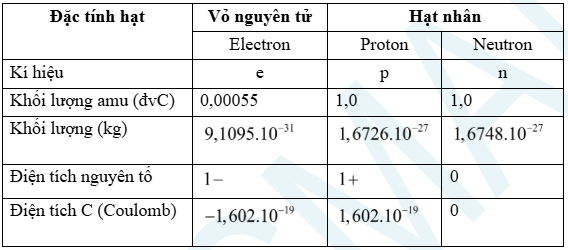
– Nguyên tử trung hòa về điện nên số proton (p) = số electron (e).
2. Kích thước và khối lượng nguyên tử
– Nguyên tử có kích thước rất nhỏ, thường dùng đơn vị nanomet (nm) hay angstrom (Å):
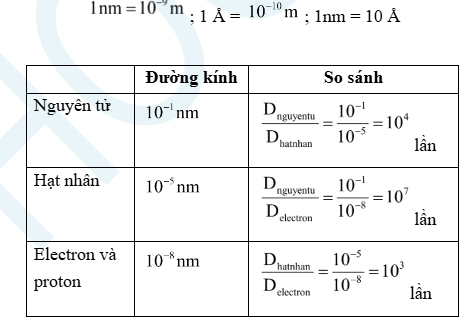
Electron chuyển động xung quanh hạt nhân trong không gian rỗng của nguyên tử.
– Khối lượng nguyên tử rất nhỏ, dùng đơn vị amu hay đvC:

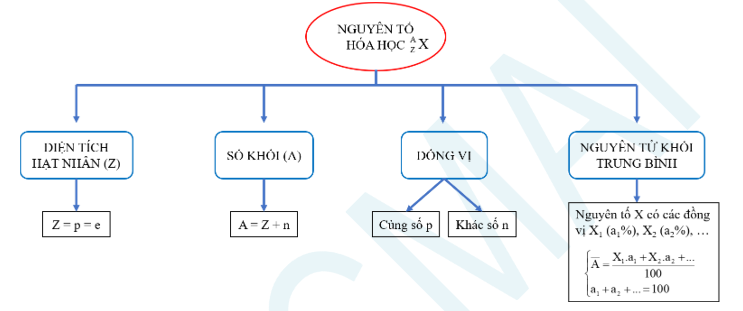
II. Hạt nhân nguyên Tử. Nguyên tố hóa học. Đồng vị
III. Cấu tạo vỏ nguyên tử
1. Sự chuyển động của electron trong nguyên tử
– Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân, không theo quỹ đạo xác định.
2. Orbital
– Là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron là lớn nhất (khoảng 90%). Kí hiệu: AO (Atomic Orbital).
– Những electron chuyển động gần hạt nhân hơn chiếm mức năng lượng thấp hơn (trạng thái bền hơn). Những electron chuyển động ở xa hạt nhân có năng lượng cao hơn.
– Dựa trên sự khác nhau về trạng thái của electron trong nguyên tử, người ta phân loại thành các orbitan s (dạng hình cầu), orbitan p (dạng hình số 8 nổi), orbitan d và orbitan f (có hình dạng phức tạp).
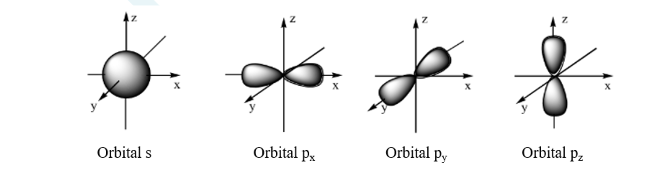
3. Lớp và phân lớp electron

IV. Cấu hình electron nguyên tử
1. Mức năng lượng
– Các electron sẽ điền theo thứ tự vào các lớp có năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s …
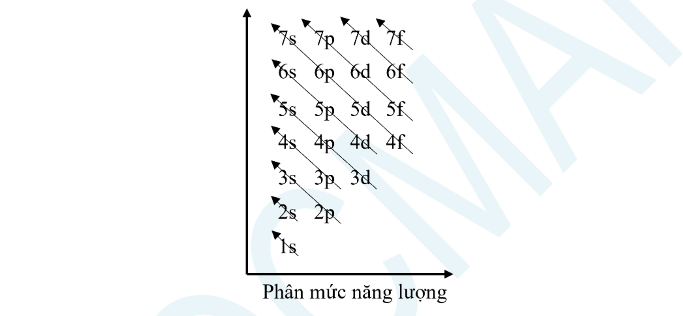
2. Cấu hình electron
Sự phân bố các electron vào orbital trong nguyên tử tuân theo các quy tắc và nguyên lí:
Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa hai electron và có chiều tự quay ngược nhau.
Nguyên lí vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao.
Quy tắc Hun: Trong cùng một phân lớp, các electron sẽ phân bố trên orbital sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau.
Cách viết cấu hình electron:
Bước 1: Xác định số electron của nguyên tử (Z).
Bước 2: Xác định thứ tự mức năng lượng: 1s 2s 2p 3s 3p 4s 3d 4p 5s …
Bước 3: Điền các electron vào các phân lớp theo thứ tự mức năng lượng (chú ý phân lớp s tối đa 2e, phân lớp p tối đa 6e, phân lớp d tối đa 10e, phân lớp f tối đa 14e).
Bước 4: Viết cấu hình electron theo thứ tự lần lượt các lớp: 1s 2s 3s 3p 3d 4s 4p 4d 5s …
3. Mối liên hệ giữa lớp electron ngoài cùng với loại nguyên tố
| Số electron lớp ngoài cùng |
Loại nguyên tố | Tính chất |
| 8 | Khí hiếm | Tương đối trơ về mặt hóa học. |
| 1, 2 hoặc 3 | Kim loại (trừ H, Be và B) | Có xu hướng nhường electron, trở thành cation. |
| 5, 6 hoặc 7 | Thường là phi kim | Có xu hướng nhận electron, trở thành anion. |
| 4 | Phi kim (khi có Z nhỏ) hoặc kim loại (khi có Z lớn) |
Chương II: Bảng tuần hoàn các nguyên tố hóa học và Định luật tuần hoàn.
I. Bảng tuần hoàn
1. Cấu tạo bảng tuần hoàn
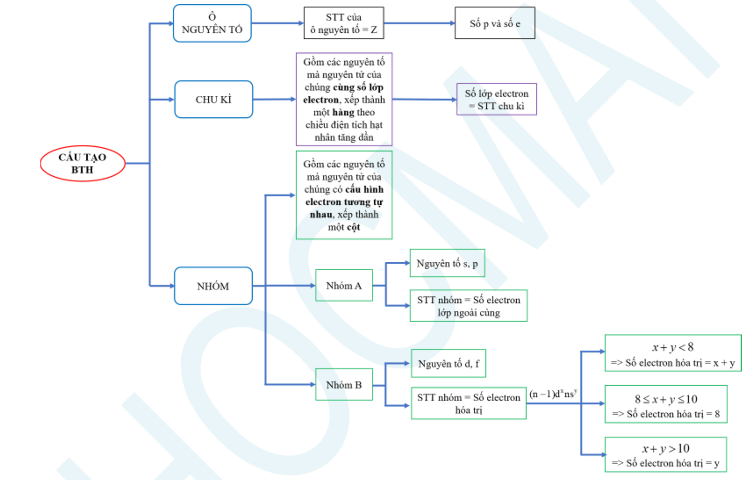
2. Nguyên tắc sắp xếp
+ Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
+ Các nguyên tố có cùng số electron hóa trị trong nguyên tử được sắp xếp thành một cột.
II. Những tính chất biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân
1. Sự biến đổi về hóa trị của các nguyên tố
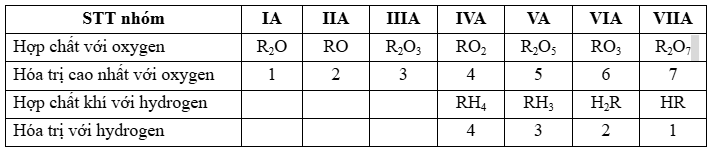
– Nhận xét: Nguyên tố phi kim R có oxide cao nhất là R2O và hợp chất khí với hydrogen là RH8-n.
2. Quy luật biến thiên tính chất các nguyên tố trong bảng tuần hoàn
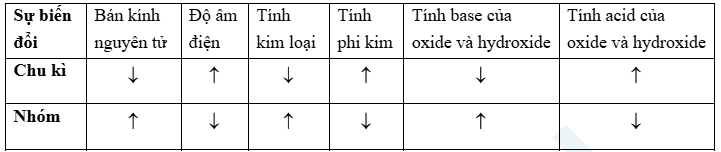
III. Định luật tuần hoàn
1. Nội dung
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
2. Ý nghĩa
– Từ vị trí cấu tạo nguyên tử.
– Từ vị trí tính chất hóa học cơ bản.
– So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận.