1. Đồng vị
- Đồng vị là những nguyên tố có cùng số proton nhưng khác nhau về số nơtron do đó số khối A khác nhau.
- Các nguyên tố hóa học là hỗn hợp của nhiều đồng vị, các đồng vị cùng một nguyên tố hóa học.
- Có 2 loại đồng vị: Đồng vị bền và đồng vị không bền.
- Hầu hết các đồng vị có số hiệu nguyên tử Z > 82 không bền (hay còn gọi là các đồng vị phóng xạ)
VD: Nguyên tố hidro có 3 đồng vị là ![]()
2. Nguyên tử khối
ĐN: Nguyên tử khối là khối lượng của nguyên tử. Khối lượng của nguyên tử bằng tổng khối lượng của proton, notron và electron trong nguyên tử đó. Proton và nơ tron đều có khối lượng xấp xỉ 1u còn electron có khối lượng nhỏ hơn rất nhiều, khoảng 0,00055u. Do đó, có thể coi nguyên tử khối xấp xỉ số khối của hạt nhân.
3. Nguyên tử khối trung bình
Nguyên tử khối của các nguyên tử có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỷ lệ tương ứng.
Giả sử nguyên tố X có 2 đồng vị A và B. Kí hiệu A,B đồng thời là nguyên tử khối của 2 đồng vị, tỉ lệ phần trăm số nguyên tử tương ứng là a và b. Khi đó: nguyên tử khối trung bình của nguyên tố X là: 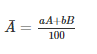
Có thể coi nguyên tử khối bằng số khối trong những phép toán không cần độ chính xác cao.



























