1. Cấu hình electron của lưu huỳnh
Trong các hợp chất của lưu huỳnh với những nguyên tố có độ âm điện nhỏ hơn (kim loại, hiđro…), nguyên tố lưu huỳnh có số oxi hóa là -2.
Trong các hợp chất cộng hóa trị của lưu huỳnh với những nguyên tố có độ âm điện lớn hơn (oxi, clo…), nguyên tố S có số oxi hóa +4 hoặc +6.
Đơn chất lưu huỳnh số oxi hóa = 0 có số oxi hóa trung gian giữa -2 và +6. Khi lưu huỳnh tham gia phản ứng, nó thể hiện tính oxi hóa hoặc tính khử.
2. Lưu huỳnh tác dụng với kim loại và hiđro
- Lưu huỳnh thể hiện tính oxi hóa, số oxi hóa của lưu huỳnh giảm từ 0 xuống -2.
Với điều kiện nhiệt độ cao, lưu huỳnh sẽ tác dụng với hidro và kim loại, tạo ra sản phẩm hidro sunfua hoặc sunfua. Phương trình phản ứng:
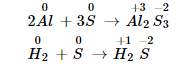
- Lưu huỳnh thể hiện tính khử, số oxi hóa của lưu huỳnh tăng từ 0 lên +4 hoặc +6.
Khi tác dụng với thủy ngân ở điều kiện nhiệt độ cao sẽ tạo ra muối thủy ngân (II) sunfua. Phương trình phản ứng:
![]()
3. Lưu huỳnh tác dụng với phi kim
Lưu huỳnh có thể tác dụng với một số phi kim (oxi, clo, flo…) ở điều kiện thích hợp. Trong các phản ứng này, lưu huỳnh thể hiện tính khử khi số oxi hóa tăng từ 0 lên +4 hoặc +6.
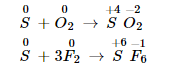
4. Ứng dụng của lưu huỳnh
Trong nhiều ngành công nghiệp, lưu huỳnh là nguyên quan trọng dùng để:
- Điều chế axit sunfuric: 90%
- Dùng để lưu hóa caosu, chế tạo diêm, sản xuất chất tẩy trắng bột giấy, chất dẻo, phẩm nhuộm, dược phẩm, chất trừ sâu…:10%
5. Sản xuất lưu huỳnh
- Khai thác trong tự nhiên: Để có thể khai thác được lưu huỳnh trong tự nhiên, người ta dùng hệ thống thiết bị nén nước siêu nóng ở nhiệt độ 170 độ C vào mỏ lưu huỳnh để đẩy lưu huỳnh nóng lên trên mặt đất.
- Sản xuất từ hợp chất:




























