1. Lớp electron
Trong nguyên tử, các e được sắp xếp thành từng lớp, các lớp được sắp xếp từ gần hạt nhân ra ngoài. Các e có năng lượng gần bằng nhau được sắp xếp trên cùng 1 lớp.
– Các e ở lớp trong có sự liên kết chặt hơn e ở các lớp ngoài.
– Năng lượng của e lớp trong thấp hơn năng lượng của e lớp ngoài (năng lượng của e phụ thuộc vào số thứ tự của lớp).
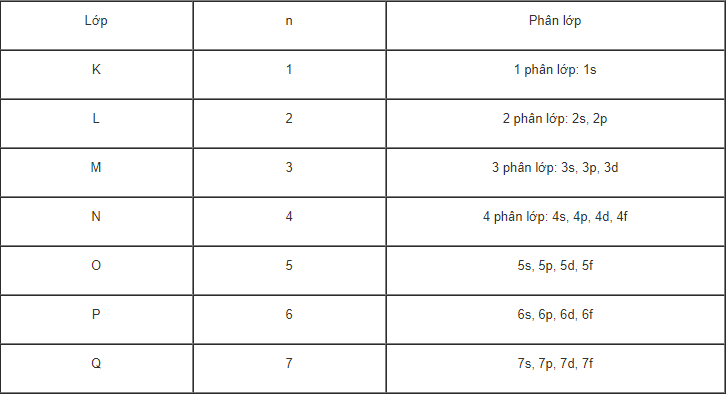
– Thứ tự các lớp e được ghi bằng các số nguyên n = 1,2,3….,7
Tên lớp: K L M N O P Q
Lớp K có n = 1 là lớp gần hạt nhân nhất, lớp Q có n=7 là lớp xa hạt nhân nhất.
2. Phân lớp electron
Mỗi phân lớp e chia thành các phân lớp được kí hiệu bằng các chữ cái viết thường: s, p, d, f…
– Các e ở lớp trên cùng một phân lớp có năng lượng bằng nhau. Số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.Lớp thứ n có n phân lớp e. Tuy nhiên, trên thực tế, với các nguyên tố đã biết, chỉ có số e điền vào 4 phân lớp: s, p, d và f.
Các e ở phân lớp s được gọi là các electron s, các e ở phân lớp p được gọi là các electron p….