
1, Hợp chất sắt (II)
Hợp chất sắt (II) có tính khử và tính oxi hóa.
- Fe2+ → Fe3+ + 1e
- Fe2+ + 2e → Fe
a, Sắt (II) oxit:
- Là chất rắn màu đen, không có trong tự nhiên.
- Tác dụng với axit tạo thành muối sắt (II); Tác dụng với axit có tính oxi hóa mạnh tạo thành muối sắt (II).
- Điều chế bằng cách dùng CO hay H2 khử sắt (III) oxit ở 500 độ C.
b, Sắt (II) hidroxit:
- Là chất có màu trắng hơi xanh, rắn, không tan trong nước, dễ bị oxi hóa thành sắt (III) hidroxit màu nâu đỏ (trong không khí).
- Có tính bazo: tác dụng với axit (HCl, H2SO4 loãng) tạo thành muối sắt (III).
- Điều chế thu được sản phẩm tinh khiết trong môi trường không có oxi.
c, Muối sắt (II):
- Hầu hết tan trong nước và kết tinh ở dạng ngậm nước, dễ bị oxi hóa thành muối sắt (III).
- Dùng pha chế sơn, diệt sâu bọ, mực nhuộm vải.
2, Hợp chất sắt (III)
Tác dụng với một số kim loại và một vài hợp chất có tính khử:
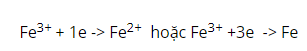
a, Sắt (III) oxit:
- Chất rắn màu đỏ nâu, không tan trong nước, dễ tan trong dung dịch axit mạnh.
- Ở nhiệt độ cao, được điều chế qua phản ứng phân hủy sắt (III) hidroxit.
- Sắt (III) dùng để luyện gang.
b, Sắt (III) hidroxit.
Chất rắn màu nâu đỏ không tan trong nước, dễ tan trong dung dịch axit tạo muối sắt (III).
c, Muối sắt (III).
- Hầu hết tan trong nước, kết tinh ở dạng ngậm nước, dễ bị khử thành muối sắt (II).
- Dùng làm chất xúc tác (FeCl3), pha chế sơn chống gỉ (Fe2O3)
Hi vọng với bài viết này sẽ giúp ích cho các em trong quá trình học lớp 12.


























