Ở bài viết này, chúng ta sẽ cùng Thầy Vũ Khắc Ngọc (giáo viên môn Hóa học tại Hệ thống Giáo dục HOCMAI) đi tìm hiểu về Amoniac và muối amoni.
I. Amoniac (NH3)
1. Cấu tạo của NH3.
Phân tử NH3 có dạng hình tháp tam giác. 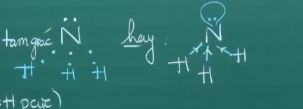
NH3 là phân tử phân cực, tan rất tốt trong nước.
Trên nguyên tử NH3 còn một đôi e chưa liên kết.
2. Tính chất vật lý
NH3 là khí không màu, có mùi khai, độc, nhẹ hơn không khí, tan tốt trong nước.
3. Tính chất hóa học.
NH3 có tính bazo yếu: Đổi màu chỉ thị (quỳ tím sang xanh, phenolphtalein sang hồng).
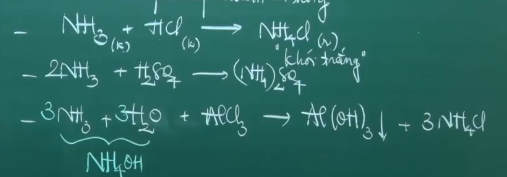
NH3 có tính khử: 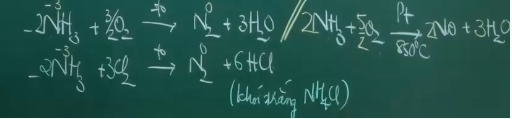
4. Điều chế và ứng dụng
Ứng dụng: sản xuất HNO3, các loại phân đạm, tổng hợp hidragin dùng để làm nhiên liệu cho tên lửa và các chất sinh hàn.
Điều chế:
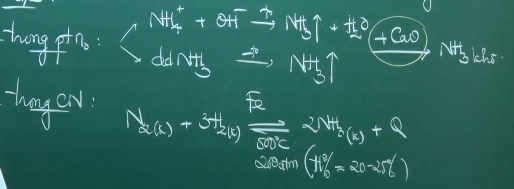
II. Muối amoni (NH4+)
1. Tính chất vật lý
Tất cả Muối amoni đều tan trong nước.
2. Tính chất hóa học.
*Phản ứng trao đổi: Dung dịch muối amoni có đầy đủ tính chất của muối.
Ion NH4+ có tính axit hay muối amoni bị thủy phân trong dung dịch kiềm.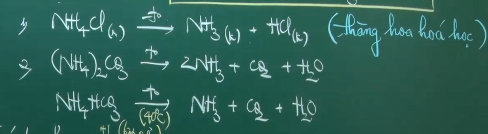
*Phản ứng nhiệt phân:
- Gốc axit không có tính oxi hóa.
- Gốc axit có tính oxi hóa.
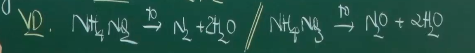
Hy vọng với bài viết này sẽ giúp ích cho các em trong quá trình học môn Hóa học lớp 11.


























