Ở bài viết này, chúng ta sẽ cùng Thầy Vũ Khắc Ngọc (giáo viên môn Hóa học tại Hệ thống Giáo dục HOCMAI) đi tìm hiểu về “Anken”.
I, Dãy đồng đẳng, đồng phân, danh pháp của anken.
1, Dãy đồng đẳng
Dãy đồng đẳng của anken bao gồm etilen (C2H4), propilen (C3H6), butilen (C4H10)… có tính chất tương tự etilen.
Công thức phân tử chung là: CnH2n (n>=2).
2, Đồng phân.
a, Đồng phân cấu tạo.
- Đồng phân vị trí liên kết đôi:
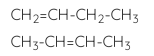
- Đồng phân phân mạch cacbon:
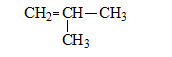
b, Đồng phân hình học:
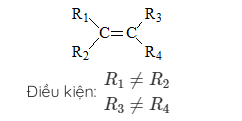
3, Danh pháp.
a, Tên thông thường.
Tên anken = Tên ankan đổi đuôi an thành ilen.
Ví dụ: CH2=CH2 (etilen); CH2=CH-CH3 (propilen).
b, Tên thay thế.
Tên anken = Tên ankan đổi đuôi an thành en.
Gọi tên theo thứ tự: Số chỉ vị trí nhánh+tên nhánh+tên C mạch chính+số chỉ liên kết đôi+en.
II, Tính chất vật lí:
- Chất khí từ C2H4 -> C4H8.
- Từ C5H10 trở đi là chất lỏng hoặc chất rắn.
- Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng tăng dần theo chiều tăng của phân tử khối.
- Các anken đều nhẹ hơn nước và không tan trong nước.
III, Tính chất hóa học.
Anken có một liên kết đôi C=C:
- Liên kết đôi là trung tâm phản ứng.
- Phản ứng phá vỡ liên kết pi kém bền.
a, Phản ứng cộng:
- Cộng hidro (phản ứng hidro hóa):
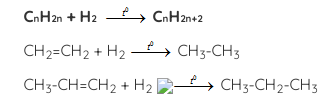
- Cộng halogen (phản ứng halogen hóa)

- Cộng HX:
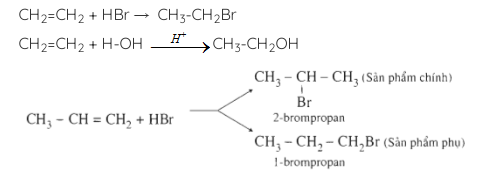
b, Phản ứng trùng hợp:
![]()
Tên polime=poli+tên monome.
c, Phản ứng oxi hóa:
- Oxi hóa hoàn toàn:
![]()
- Oxi hóa không hoàn toàn:
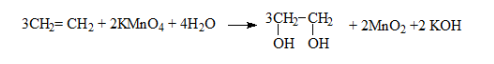
IV, Điều chế:
- Trong phòng thí nghiệm: Etilen được điều chế từ ancol etylic theo phương trình:
![]()
- Trong công nghiệp: Anken được điều chế từ ankan làm nguyên liệu tổng hợp hóa học, tổng hợp polime, làm dung môi,…
![]()
Hy vọng với bài viết này sẽ giúp ích cho các em trong quá trình học môn Hóa học lớp 11.


























