
I, Crom
1, Vị trí, cấu tạo.
Crom là kim loại chuyển tiếp, thuộc nhóm VIB, chu kì 4.
Số OXH biến đổi từ +1 đến +6, phổ biến hơn là +2,+3,+6 trong hợp chất.
Crom có cấu tạo mạng tinh thể lập phương tâm khối ở nhiệt độ thường.
2, Tính chất vật lí.
Crom: Màu trắng bạc, cứng (chỉ kém kim cương), khó nóng chảy (tnc 1890oC)
3, Tính chất hóa học.
a, Tác dụng với axit.
Crom khử H+ trong dung dịch HCl, H2SO4 loãng nóng, màng oxit bị phá hủy tạo ra muối Cr(II) và khí hidro.
![]()
Crom không tác dụng với HNO3 và H2SO4 đặc, nguội => Crom trở nên thụ động.
b, Tác dụng với phi kim.
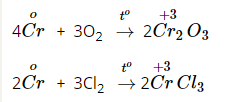
4, Ứng dụng.
- Crom dùng sản xuất thép trong công nghiệp.
- Crom dùng để mạ thép tạo vẻ đẹp và chống ăn mòn.
5, Sản xuất.
Crom tồn tại ở dạng hợp chất như quặng cromit sắt FeO,Cr2O3
II, Hợp chất của Crom.
1, Hợp chất của Crom (II)
a, Crom (II) oxit (CrO)
Tính chất vật lí: CrO là oxit bazo có màu đen.
Tính chất hóa học: Tính chất của oxit bazo và tính khử.
CrO tác dụng với HCl và H2SO4 loãng sinh ra muối crom (II) và nước:
CrO + 2HCl -> CrCl2 + H2O
b, Crom (II) hidroxit (Cr(OH)2)
Tính chất vật lí: Là 1 bazo có chất rắn màu vàng.
Tính chất hóa học:
Tính bazo: Cr(OH)2 + 2HCl -> CrCl2 + 2H2O
Tính khử: 4Cr(OH)2 + O2 + 2H2O -> 4Cr(OH)3
c, Muối Crom (II)
Muối Crom (II) đê ngoài không khí ở dạng dung dịch sẽ chuyển màu xanh lam sang xanh lục.
Muối Crom (II) có tính khử mạnh: 2CrCl2 + Cl2 -> 2CrCl3
2, Hợp chất Crom (III)
a, Crom (III) oxit – Cr2O3
Cr2O3 Là oxit lưỡng tính có màu xanh lục, tan trong dung dịch axit và kiềm đặc.
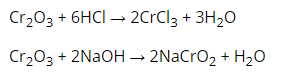
b, Hidroxit Cr(OH)3
Hidroxit Cr(OH)3 kết tủa nhầy, màu lục nhạt tan trong dung dịch axit và dung dịch kiềm, là hidroxit lưỡng tính.
Cr(OH)3 + 3HCl -> CrCl3 + 3H2O
c, Muối crom (III)
Muối crom (III) có tính oxi hóa và dễ bị khử thành muối crom (II) trong môi trường axit:
![]()
Muối crom (III) có tính khử, bị những chất oxi hóa mạnh oxi hóa thành muối crom (IV):
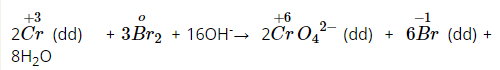
3, Hợp chất crom (IV)
a, Crom (IV) oxit (CrO3)
Tính chất vật lí: Chất rắn, màu đỏ thẫm.
Tính chất hóa học: CrO3 làm chất hữu cơ (S, P, C, NH3, C2H5OH,…) bốc cháy và CrO3 bị khử thành Cr2O3
![]() CrO3 tác dụng với nước thành hỗn hợp axit:
CrO3 tác dụng với nước thành hỗn hợp axit:
2CrO3 + H2O -> H2Cr2O7
b, Muối cromat và diccrommat.
Muối cromat có chứa ion: CrO42- (màu vàng)
Muối diccrommat có chứa ion: Cr2O72- (màu da cam)
=> Hai loại muối trên chuyển hóa lẫn nhau theo một cân bằng: 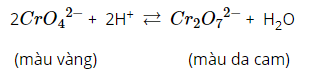
Có tính oxi hóa mạnh:
K2Cr2O7 + 6FeSO4 + 7H2SO4 -> Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O


























