Ở bài viết này, chúng ta sẽ cùng Thầy Vũ Khắc Ngọc (giáo viên môn Hóa học tại Hệ thống Giáo dục HOCMAI) đi tìm hiểu về “Hợp chất của cacbon”.
I, Cacbon monooxit – CO.
1, Cấu tạo và tính chất vật lý.
- Cấu tạo của CO là C≡O
- CO là chất khí, không màu, không mùi, không vị, tan rất ít trong nước và rất bền với nhiệt.
- CO kết hợp với hemoglobin ở trong máu tạo thành hợp chất bền làm cho hemoglobin mất tác dụng vận chuyển O2 nên Co là khí độc.
2, Tính chất hóa học.
- Phân tử CO có liên kết ba bền vững nên ở nhiệt độ thường rất trơ và chỉ hoạt động khi nhiệt độ cao.
- CO không tác dụng với bazo và dung dịch axit ở nhiệt độ thường.
- CO có tính khử mạnh: Tác dụng với các phi kim, khử oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại.
3, Điều chế.
+ Trong công nghiệp: 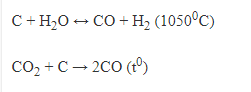
+ Trong phòng thí nghiệm:
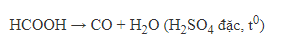
II, Cacbon đioxit – CO2.
1, Cấu tạo và tính chất vật lí.
Cấu tạo của CO2 là O=C=O.
CO2 là khí không màu, vị hơi chua, tan ít trong nước. Thành phần chính của nước đá khô là CO2 bị làm lạnh đột ngột.
2, Tính chất hóa học.
a, CO2 là oxit axit.
- CO2 tan trong nước tạo thành axit cacbonic.
- CO2 tác dụng với oxit bazo tạo thành muối.
- CO2 tác dụng với dung dịch bazo tạo muối và nước.
b, CO2 tác dụng với các chất khử mạnh.
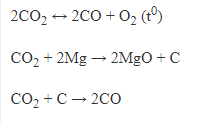
c, CO2 sản xuất ure.
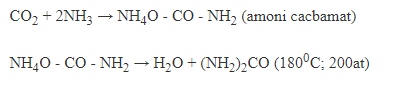
3, Điều chế.
+ Dùng để lên men bia rượu.
![]()
+ Dùng để đốt cháy nguyên liệu.
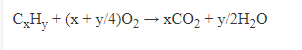
+ Trong công nghiệp:
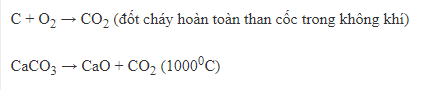
+ Trong phòng thí nghiệm:
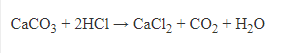
3, Nhận biết.
Tạo kết tủa trắng với dung dich nước vôi trong dư.
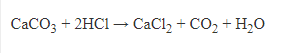
III, Muối cacbonat.
1, Tính tan.
Muối cacbonat trung hòa kim loại kiềm, amoniac và các muối dễ tan trong nước.
2, Tính chất hóa học.
+Sự thủy phân: Muối cacbonat của kim loại kiềm bị thủy phân mạnh tạo môi trường kiềm.
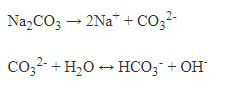
+Sự nhiệt phân:
- Muối cacbonat tan không bị nhiệt phân, muối cacbonat không tan bị nhiệt phân.
![]()
- Tất cả các muối hidrocacbonat đều bị nhiệt phân:
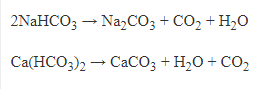
+Muối cacbonat có đầy đủ tính chất chung của muối.
3, Nhận biết.
Muối cacbonat tác dụng với axit -> CO2.
Hy vọng với bài viết này sẽ giúp ích cho các em trong quá trình học môn Hóa học lớp 11.


























