
-
Bán kính nguyên tử
Trong một chu kỳ, nguyên tử các nguyên tố có cùng số lớp electron nhưng khí điện tích hạt nhân tăng, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng theo, vì vậy bán kinh nguyên tử giảm dần.
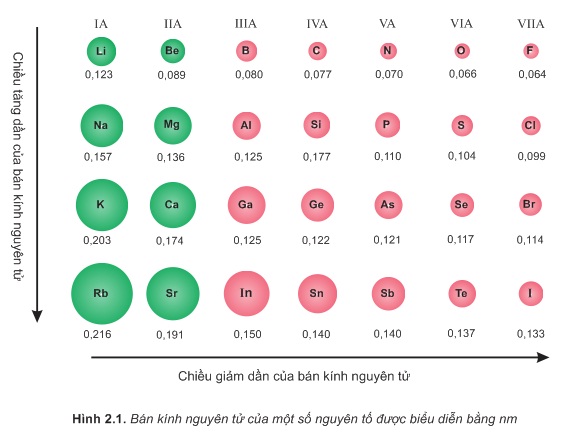
Bán kính nguyên tử các nguyên tố nhóm A biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
2. Năng lượng ion hóa
Năng lượng ion hóa thứ nhất (I1) của nguyên tử là năng lượng tối thiểu cần để tách electron thứ nhất ra khỏi nguyên tử ở trạng thái cơ bản.
Công thức tính năng lượng ion hóa: k.J/mol
Năng lượng ion hóa thứ 2, thứ 3 được kỳ (I2, I3) là năng lượng cần để tách eletron thứ 2, 3 ra khỏi ion tương ứng.
Các giá trị năng lượng ion hóa thứ nhất của nguyên tử các nguyên tố nhóm An được thể hiện theo bảng dưới đây:
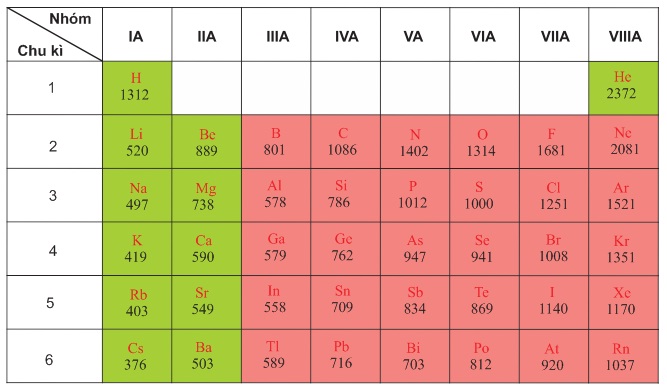
Sự biến đổi năng lượng ion hóa theo Z được biểu hiện theo biểu đồ dưới đây:
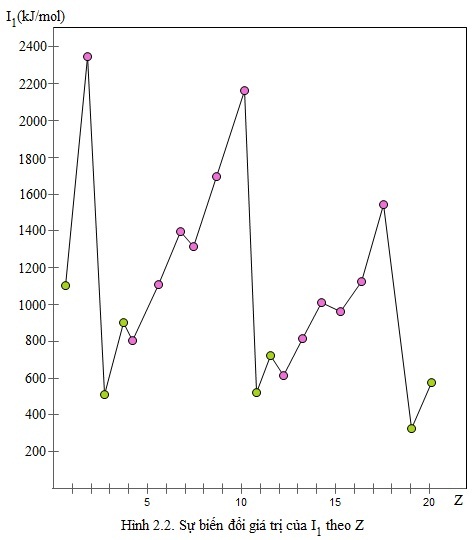
Trong một chu kì: Theo chiều tăng của điện tích hạt nhân, lực liên kết giữa hạt nhân và electron lớp ngoài cùng tăng, làm cho năng lượng ion hóa nói chung cũng tăng theo.
Trong cùng một nhóm A: Theo chiều tăng của điện tích hạt nhân, khoảng cách giữa electron lớp ngoài cùng đến hạt nhân tăng, lực liên kết giữa electron lớp ngoài cùng và hạt nhân giảm, do đó năng lượng ion hóa nói chung giảm.
2. Độ âm điện
Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên từ đó khi tạo thành liên kết hóa học.
Với độ âm điện nguyên tử của nguyên tố càng lớn thì tính phi kim của nguyên tố càng mạnh. Độ âm điện của nguyên tử nguyên tố càng nhỏ thì tính kim loại càng mạnh.
Bảng dưới đây là giá trị độ âm điện nguyên tử một số nguyên tố nhóm A theo Pau-linh:
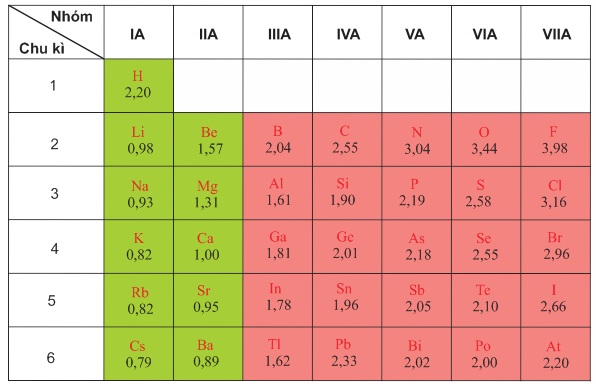
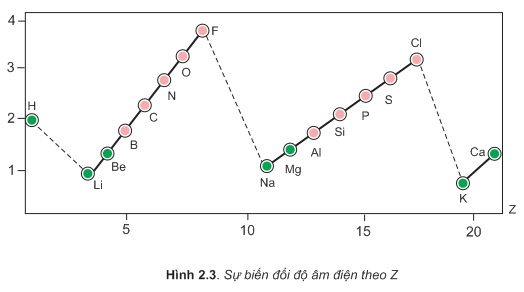
Ta có thể thấy:
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện của nguyên tử các nguyên tố thường tăng dần.
Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, độ âm điện của nguyên tử các nguyên tố thường giảm dần.


























