I, Sự biến đổi tính kim loại, phi kim
1. Tính kim loại, tính phi kim
Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron để trở thành ion dương.
Nguyên tử nguyên tố có tính kim loại càng mạnh thì càng dễ nhường electron.
Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm.
Nguyên tử nguyên tố có tính phi kim càng mạnh thì càng dễ nhận electron.
2. Sự biến đổi tính kim loại, tính phi kim
Trong mỗi chu kì theo chiều tăng của điện tích hạt nhân, tính kim loại của các nguyên tố giảm dần đồng thời tính phi kim tăng dần.
Trong một chu kì, theo chiều tăng của điện tích hạt nhân (từ trái sang phải): Năng lượng ion hóa, độ âm điện tăng dần đồng thời bán kính nguyên tử giảm dần làm cho khả năng nhường electron giảm nên tính kim loại giảm, khả năng nhận electron tăng nên tính phi kim tăng.
Đối với nhóm A, quy luật được giải thích như sau:
+ Theo chiều tăng dần của điện tích hạt nhân (từ trên xuống dưới) năng lượng ion hóa, độ âm điện giảm dần đồng thời bán tính nguyên tử tăng nhanh làm cho khả năng nhường electron tăng. Vì vậy, tính kim loại tăng, khả năng nhận electron giảm nên tính phi kim giảm.
+ Tính kim loại, phi kim của các nguyên tố phụ thuộc vào cấu hình electron nguyên tử. Cấu hình electron biến đổi nên tính kim loại và tính phi kim biến đổi tuần hoàn.
=> Tính kim loại, tính phi kim của các nguyên tố nhóm AA biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
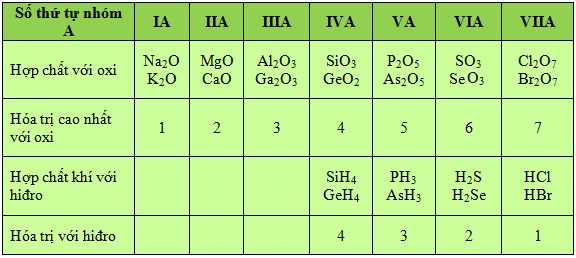
II, Sự biến đổi hóa trị của các nguyên tố
Trong một chu kỳ đi từ trái sang phải, hóa trị cao nhất của các nguyên tố với oxi tăng lần lượt từ 1 đến 7, còn hóa trị với hidro của các phi kim giảm từ 1 đế 4.
- Hóa trị cao nhất của một nguyên tố với oxi, hóa trị với hiđro của các phi kim biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
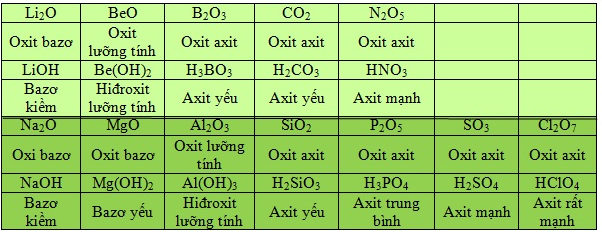
III, Sự biến đổi tính axit, bazo
Trong một chu kỳ, theo chiều tăng dần của điện tích hạt nhân, tính bazo của oxit và hidro tương ứng giảm dần đồng thời tính axit của chúng tăng dần.
Trong nhóm A, theo chiều tăng dần của điện tích hạt hân, tính bazo của các oxit và hidroxit tương ứng tăng dần, đồng thời tính axit của chúng giảm dần.
=> Tính axit – bazơ của các oxit và hiđroxit tương ứng của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Định luật tuần hoàn được phát biểu như sau:
“Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.”



























