
I, Nhôm
1, Vị trí và cấu tạo.
- Nhôm có sô hiệu nguyên tử là 13, thuộc nhóm IIIA, chu kì 3
- Số oxi hóa bền là +3
- Có cấu tạo mạng tinh thể lập phương tâm diện.
2, Tính chất vật lí.
Màu trắng bạc, mềm, dễ kéo mỏng, dẫn nhiệt và dẫn điện tốt.
3, Tính chất hóa học.
a, Tác dụng với phi kim (điều kiện nhiệt độ): 4Al + 3O2 -> 2Al2O3
b, Tác dụng với axit
- Nhôm tác dụng với dung dịch axit (HCl, H2SO4) tạo thành muối và H2.
2Al + 6H+ -> 2Al3+ + 3H2
- Nhôm tác dụng với dung dịch axit (có tính oxi hóa mạnh) tạo thành muối và sản phẩm khử và H2O.
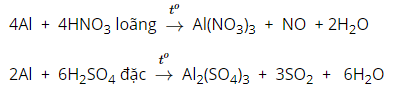
(Nhôm không tác dụng với H2SO4 VÀ HNO3 đặc nguội)
c, Tác dụng với oxit kim loại.
Nhôm khử được nhiều oxit kim loại thành kim loại tự do ở nhiệt độ cao:
2Al + Fe2O3 -> Al2O3 + 2Fe (điều kiện nhiệt độ)
d, Tác dụng với dung dịch kiềm.
2Al + 2NaOH + 6H2O -> 2Na(dd) + 3H2
4, Ứng dụng.
- Nhôm dùng để chế tạo vỏ máy bay, tàu vũ trụ, tên lửa do nhẹ và bền với không khí và nước.
- Dùng làm dây dẫn điện cao áp, vật trao đổi nhiệt, đồ nội thất, hàn gắn đường ray.
II, Một số hợp chất quan trọng của nhôm.
1, Nhôm oxit (Al2O3)
- Tính chất vật lí: Chất rắn màu trắng và không tan trong nước, nóng chảy ở nhiệt độ 2050 độ C.
- Tính chất hóa học: Tác dụng được với dung dịch axit và dung dịch kiềm
Al2O3 + 6HCl -> 2AlCl3 + 3H2O
- Ứng dụng: Dùng làm đồ trang sức, chế tại những đồ dùng mang tính kĩ thuật đòi hỏi sự chính xác,…
2, Nhôm hidroxit.
Tính chất vật lí: Nhôm hidroxit là chất kết tủa keo, màu trắng, dễ bị nhiệt phân hủy và không tan trong nước.
Tính chất hóa học:
+ Bị nhiệt phân thành nhôm axit ở điều kiện nhiệt độ: 2Al(OH)3 -> Al2O3 + 3H2O
+ Tan trong axit và bazo: Al(OH)3 + 3HCl -> AlCl3 + 3H2O
Điều chế: Cho muối nhôm phản ứng với dung dịch muối Na2CO3 hoặc NH3.
![]()
3, Nhôm sunfat – Al2(SO4)3
- Là chất bột, có màu trắng, bị phân hủy nhiệt trên 770 độ C.
- Phèn chua tồn tại ở dạng tinh thể có vị hơi chua và chát: K2SO4.Al2(SO4)3.24H2O hoặc KAl(SO4)2.12H2O.


























