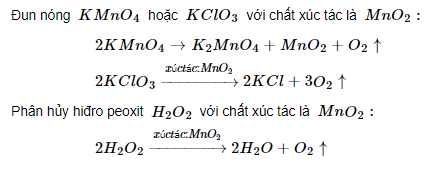1. Cấu tạo phân tử oxi
Công thức cấu tạo của phân tử oxi là O = O (hai nguyên tử O liên kết cộng hóa trị không cực tạo thành phân tử oxi.
Cấu hình electron của oxi: ![]()
2. Tính chất vật lí và trạng thái tự nhiên của oxi
Tính chất vật lí:
Oxi là nguyên tố không màu, không mùi, nặng hơn không khí, có d=32/29. Dưới áp suất của khí quyển, oxi hóa lỏng ở nhiệt độ – 183 độ C.
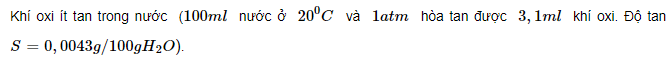
Trạng thái tự nhiên của oxi:
Lượng oxi trong tự nhiên là sản phẩm của quá trình quang hợp. Nhờ quá trình quang hợp của cây xanh đã tạo ta lượng oxi gần như không đổi trong không khí (cây xanh là nhà máy sản xuất cacbohiđrat và oxi từ cacbon đioxit và nước dưới tác dụng của ánh sáng mặt trời).
Phương trình phản ứng: ![]()
3. Tính chất hóa học của oxi
Oxi là nguyên tố có tính phi kim, oxi có tính oxi hóa mạnh (độ âm điện 3,44 chỉ đứng sau flo 3,98, khi tham gia phản ứng, nguyên tử oxi dễ dàng nhận thêm 2e). Số oxi hóa của oxi là -2.
Tác dụng với hầu hết kim loại (trừ Au, Pt…) và phi kim (trừ các nguyên tố halogen).
Quá trình oxi hóa có phản ứng nhanh hoặc chậm phụ thuộc vào nhiệt độ, trạng thái và bản chất của chất.
4. Ứng dụng của oxi
Oxi quyết định sự sống của con người và động vật. Hằng năm, trên thế giới sản xuất hàng trục triệu tấn oxi để đáp ứng được nhu cầu đời sống cũng như sản xuất.
5. Sản xuất oxi
Sản xuất trong công nghiệp
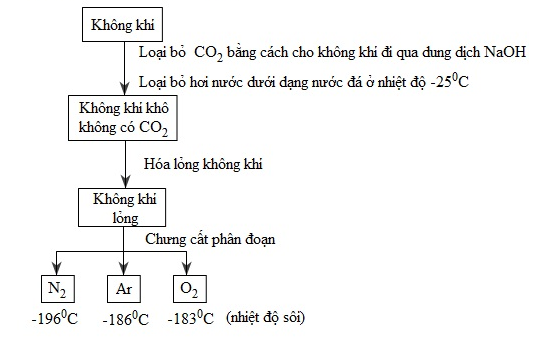
Từ không khí: Sau khi không khí đã loại bỏ cacbonic, bụi và hơi nước, không khí sẽ được hóa lỏng, chưng cất phân đoạn không khí lỏng ta thu được khí oxi ở – 183 độ C. Dưới đây là sơ đồ sản xuất không khí:
Điều chế từ nước:

Sản xuất trong phòng thí nghiệm
Điều chế oxi bằng phản ứng thủy phân những hợp chất chứa oxi, kém bền với nhiệt: