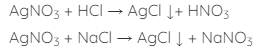1. Hidro clorua – axitclohidric
1.1 Hidroclorua
- Cấu tạo phân tử: Ví clo có độ âm điện lớn hơn hidro nên cặp electron bị lệch về phía clo, dưới đây là công thức của electron:
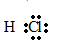
- Tính chất:
Hidroclorua là chất khí không màu, tan nhiều trong nước (1 lít nước có thể hòa tan 500 lít HCl)
Hidroclorua nặng hơn không khí, không làm quỳ tím (khô) hóa đỏ và không tác dụng với CaCo3…
1.2 Axit clohidric
- Tính chất vật lí:
Axitclohidric là chất lỏng không màu, có mùi xốc, HCl đặc có C% sấp xỉ bằng 37%, D = 1,19 (g/ml). HCl đặc bốc khói trong không khí ẩm.
- Tính chất vật lí:
Axitclohidric là axit mạnh có đầy đủ tính chất vật lí của một axit (làm đổi màu quỳ tìm, có tác dụng với kim loại đứng trước hidro, tác dụng với bazo, oxit bazo tạo muối và nước, tác dụng với muối).
Một số phương trình phản ứng: 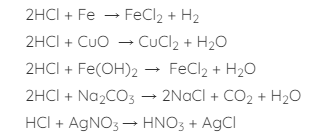
Axitclohidric có tính khử, trong phân tử HCl, nguyên tố clo có số oxi hóa mạnh nhất (-1), khi dung dịch HCl đặc tác dụng với chất oxi hóa mạnh thì HCl bị oxi hóa thành Cl2.
Ví dụ: 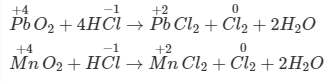
2. Muối clorua và nhận biết muối clorua
2.1 Một số muối clorua
Đa số muối clorua tan nhiều trong nước, trừ AgCl không tan, và CuCl, PBCl2 ít tan.
Muối NaCl là ứng dụng quan trọng nhất, ngoài việc làm muối ăn và bảo quản thực phầm, nó còn là nguyên liệu quan trọng với ngành công nghiệp hóa chất để điều chế clo, hidro, nước gia-ven, NaOH…
2.2 Cách nhận viết ion clorua
Cho vài giọt AgNO3 vào dung dịch cần phân biệt, nếu thấy xuất hiện kết tủa không tan trong axit mạnh, đó là HCl hoặc muối clorua.
Phương trình phản ứng: