Mục lục
I, Định nghĩa, phân loại, danh pháp của axit cacbonxylic
1, Định nghĩa: Axit cacbonxylic là các hợp chất hữu cơ trong phân tử có nhóm -COOH (cacbonxylic) được liên kết trực tiếp với nguyên tử cacbon hoặc nguyên tử hidro.
2, Phân loại: Ta phân loại theo những trường hợp sau:
– Nhóm cacbonxylic liên kết trực tiếp với nguyên tử hidro hoặc gốc ankyl tạo thành dãy axi no, mạch hở, đơn chức, công thức chung như sau:
![]()
– Gốc hidrocacbon là vòng thơm thì gọi là axit thơm VD: C6H5 – COOH (axit benzoic)
– Gốc hidrocacbon trong phân tử axit có chứa liên kết đôi, liên kết ba, ta gọi là axit không no.
– Trong phân tử có nhiều nhóm cabonyl (-COOH) gọi là axit đa chức.
3, Danh pháp
Tên thay thế của axi cacbonxylic mạch hở chứa không quá 2 nhóm cacbonxylic, được cấu tạo bằng cách đặt từ axit trước tên của hidrocacbon tương ứng theo mạch chính (bắt đầu từ nguyên tử C của nhóm – COOH) + oic.
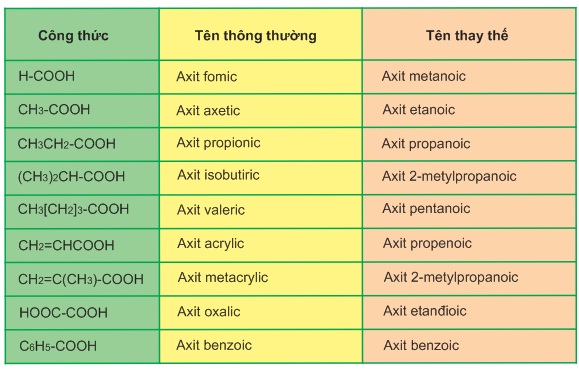
Tên thông thường được gọi như bảng sau:
II, Tính chất vật lí
Trong điều kiện thường, các axit cacboxylic đều là những chất lòng hoặc chất rắn.
Do sự phân cực ở nhóm cacboxylic và sự tạo thành liên kết hidro liên phân tử ở axit cacboxylic nên nhiệt độ sôi của axit cacboxylic cao hơn andehit, xeton và ancol.
Các axit fomic, axetic, propionic tan vô hạn trong nước. Khi số nguyên tử CC tăng lên thì độ tan trong nước giảm.
Các axit cacboxylic có vị chua riêng biệt: Axit axetic có vị chua của giấm, axit xitric có vị chua chanh, axit oxalic có vị chua của me, axit tactric có vị chua của nho ,..
III, Tính chất hóa học
1. Tính axit và ảnh hưởng của nhóm thế
Mật độ electron ở nhóm OH có sự dịch chuyển về phía nhóm C=O, nguyên tử H của nhóm OH trở nên linh động nên axit cacboxylic điện li không hoàn toàn trong nước.
![]()
Các axit cacboxylic là axit yếu. Dù vậy, chúng có đầy đủ tính chất của một axit như : tác dụng với kim loại giải phóng hiđro, làm đỏ quỳ tím, phản ứng với bazơ, đẩy được axit yếu hơn ra khỏi muối.
Trong axit no đơn chức, axit fomic, các nhóm ankyl đẩy electron về phía nhóm cacboxylic nên sẽ làm giảm lực axit:
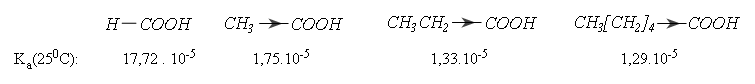
Những nguyên tử có độ âm điện lớn trong gốc R hút electron của nhóm cacboxylic, làm tăng lực axit: 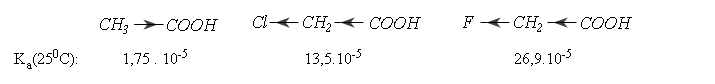
2, Phản ứng tạo thành dẫn xuất axit
- Phản ứng ancol (este hóa)
Trong những bình thủy tinh hàn kín chứa hỗn hợp phản ứng, được đun nóng ở 80 độ C. Sau phản ứng, chuẩn độ bằng dung dịch NaOH1M ta xác định được lượng axit axetic, từ đó tính được số mol este, ne, ở mỗi bình.
Phản ứng của axi axetic với etanol xúc tác axit là phản ứng thuận nghịch.
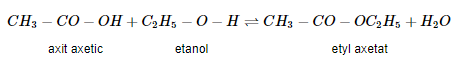
Phương trình tổng quát, phản ứng giữa axit cacbonxylic và ancol như sau: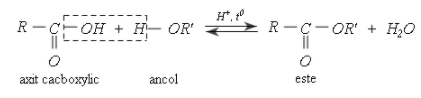
Lưu ý: Chiều thuận là phản ứng este hóa, chiều nghịch là phản ứng thủy phân este.
- Phản ứng tách nước liên phân tử, phương trình phản ứng:
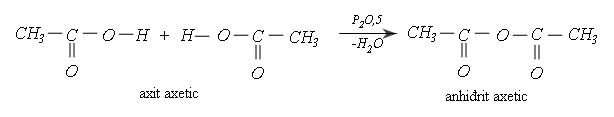
3, Phản ứng gốc hidrocacbon
- Phản ứng thế ở gốc no
Dùng photpho (P) làm chất xúc tác, Cl thế cho H ở cacbon bên cạnh nhóm cacboxyl, phương trình phản ứng:
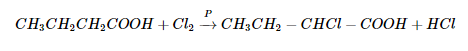
- Phản ứng thế ở gốc thơm
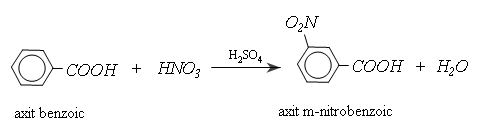
Từ phương trình trên ta có thế thấy, nhóm cacboxyl ở vòng benzen định hướng cho phản ứng thế tiếp theo vào vị trí của meta, làm cho phản ứng kho khăn hơn so với thế vào benzen.
- Phản ứng cộng vào gốc không no
Giống như hidrocacbon không no, axit không no cũng tham gia phản ứng cộng hidro, brom, clo…Ví dụ về phương trình phản ứng:

III, Điều chế và ứng dụng của axit cacboxylic
1, Điều chế axit cacbonxylic
- Điều chế trong phòng thí nghiệm: Người ta điều chế bằng cách oxi hóa hidrocacbon, ancol hoặc đi từ dẫn xuất halogen.
![]()
![]()
- Điều chế trong công nghiệp: Người ta điều chế bằng phương pháp lên men giấm, oxi hóa andehit hoặc dùng metanol và cacbon oxi (xúc tác thích hợp)…
2, Ứng dụng
Axit axetic được dùng để điều chế những chất có ứng dụng quan trọng như: axit cloaxetic (dùng tổng hợp chất diệt cỏ), enlulozơ axetat (chế tơ axetat), muối axetat của nhôm, crom, sắt (dùng làm chất cầm màu khi nhuộm vải, sợi)
Các axit béo như axit panmitic, axit stearic dùng để chế xà phòng…

























