Cùng khám phá 3 dạng bài tập thường gặp trong chương oxi – lưu huỳnh và cách “xử đẹp” chúng trong nháy mắt dưới đây nào teen 2k2 ơi!
1. Xác định % theo thể tích, % theo khối lượng của hỗn hợp khí dựa vào tỉ khối hơi
Để giải bài tập Hóa học lớp 10 dạng này trước hết bạn cần nắm rõ hệ thống công thức sau:
– Thành phần phần trăm theo thể tích của khí A trong hỗn hợp:
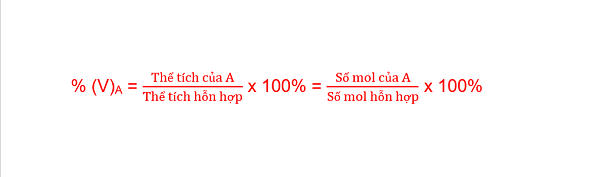
– Thành phần phần trăm theo khối lượng của A trong hỗn hợp:

– Tỉ khối của khí A so với khí B:

– Tỉ khối của hỗn hợp khí A so với khí B và tỉ khối của khí A so với hỗn hợp khí B:

– Tỉ khối của hỗn hợp khí A so với hỗn hợp khí B

Ngoài các công thức nêu trên bạn còn cần ghi nhớ công thức tính khối lượng phân tử trung bình của hỗn hợp và phân tử khối trung bình của không khí. Công thức này có sẵn trong sách giáo khoa nên bạn có thể dễ dàng tìm kiếm.
Sau khi đã nằm lòng các công thức bạn hãy ứng dụng ngay vào bài tập để hiểu kỹ hơn. Cùng thử với ví dụ sau nhé: Hỗn hợp khí A gồm oxi và ozon có tỉ khối so với hiđro là 19,2. Tính % thể tích của các khí trong A?
Cách giải:
Gọi thể tích O2 trong 1 lit hỗn hợp là x (lit)
=> thể tích O3 trong 1 lit hỗn hợp là 1-x ( lit)
Ta có:

=> Trong 1 lit hỗn hợp có 0,4 lit O2 và 0,6 lit O3
Vậy % O2 = 0,4*100/1 = 40%
%O3 = 100% – 40% = 60%
Chỉ cần vận dụng công thức thích hợp là đã có thể giải bài toán trong tích tắc, teen 2k2 hãy học ngay các công thức trên để hạ gục mọi bài tập dạng này nhé! Bạn có thể luyện tập với các bài tập tương tự sau:
- Hỗn hợp khí B gồm hiđro và cacbon(II) oxit có tỉ khối so với hiđro là 3,6. Tính % theo khối lượng của từng khí trong B?
- 1,12 lit hỗn hợp khí A gồm NO và N2O có tỉ khối so với hiđro là 16,75. Tính số mol và % theo thể tích từng khí trong hỗn hợp?
2. Dựa vào định luật bảo toàn electron
Định luật bảo toàn electron đã sớm “nhẵn mặt” với teen 2k2 trong thời trung học cơ sở, nhưng đến chương oxi – lưu huỳnh đây vẫn là công cụ hữu ích giúp bạn giải bài tập Hóa học lớp 10. Nội dung định luật là:
Tổng số electron cho = tổng số electron nhận
Vậy nên ứng dụng định luật này cho các dạng bài tập như thế nào? Khi gặp đề bài là cho hỗn hợp nhiều chất phản ứng với nhau và các phản ứng là phản ứng oxi – hóa khử thì bạn phải bật ngay trong đầu tư duy giải theo hướng bảo toàn electron.
Hãy tham khảo bài tập sau để hiểu rõ hơn: Hỗn hợp khí A gồm clo và oxi. A phản ứng hết với 1 hỗn hợp gồm 4,80 gam magiê và 8,10 gam nhôm tạo ra 37,05 gam hỗn hợp các muối clorua và oxit của 2 kim loại. Xác định thành phần phần trăm theo khối lượng và theo thể tích của hỗn hợp A?
Cách giải:
Bước 1: Viết quá trình cho nhận electron của các phản ứng trên:
Quá trình cho e:
Mg – 2e -> Mg2+
0.20– 0.04— 0.02 (mol)
Al – 3e –> Al3+
0.30– 0.90—0.30
Quá trình nhận e:
Cl2 +2e -> 2Cl–
x—- 2x—– 2x (mol)
O2 +4e -> 2O2-
y—- 4y—– 2y (mol)
Bước 2: đặt ẩn số ( x, y,… là số mol các chất đề bài yêu cầu tính)
Gọi x, y lần lượt là số mol của Cl2 và O2 trong hỗn hợp
Bước 3: lập phương trình (1) dựa vào định luật bảo toàn e
Số mol Mg = 4,80/24 = 0,20 (mol)
=> số electron Mg cho = 0,20*2=0,40 (mol)
Số mol Al = 8,10/27 = 0,30 (mol)
=> Số electron Al cho = 0,30*3 = 0,90 (mol)
Theo định luật bảo toàn e:
Số electron cho = số electron nhận
=> 2x+4y = 0,20+0,90=1,3 (1)
Bước 4: kết hợp các dữ kiện khác để lập thêm phương trình (2)
Theo định luật bảo toàn khối lượng:

Cách giải này nhanh hơn hẳn cách thông thường phải không teen 2k2 ơi? Bạn thử ứng dụng với các bài tập sau nha:
- Hoà tan hoàn toàn một lượng bột sắt vào dung dịch HNO3 thu được muối sắt (III) nitrat và hỗn hợp khí gồm 0,015 mol N2O và 0,01 mol NO. Tính khối lượng sắt đã hoà tan?
- Cho 11 gam hỗn hợp sắt và nhôm vào dung dịch H2SO4 đặc nóng thu được 10,08 lit khí SO2 (đkc). Tính thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp?
3. Kim loại tác dụng với lưu huỳnh
Nếu muốn giải bài tập Hóa học lớp 10 dạng này thì teen 2k2 cần hiểu kỹ những phần lý thuyết như sau:
Phản ứng giữa kim loại (M) và lưu huỳnh (S)
M + S -> muối sunfua
Phản ứng có thể hoàn toàn hoặc không hoàn toàn
* Phản ứng hoàn toàn thì sau pư thu được :
– Muối sunfua ( Kim loại M hết, S hết)
– Hoặc muối sunfua, Kim loại (M) dư: khi cho hh các chất trên tác dụng với dung dịch axit sẽ cho hỗn hợp khí H2S và H2
– Hoặc muối sunfua, lưu huỳnh (S) dư: khi cho các chất trên tác dụng với dung dịch axit sẽ cho khí H2S và chất rắn (S) không tan.
* Nếu phản ứng không hoàn toàn thì sau pư thu được:
– Muối sunfua, S dư, M dư: khi hoà tan trong axit thì thu đuợc hỗn hợp 2 khí H2S và H2 và 1 chất rắn (S) không tan

Nguồn: i.ytimg.com
Dưới đây là một bài tập để minh họa cho cách giải nhanh, bạn hãy theo dõi nhé: Đun nóng hoàn toàn hỗn hợp bột gồm sắt và lưu huỳnh. Đem hoà tan chất rắn sau phản ứng trong dung dịch HCl dư thấy có 4,48 lit khí thoát ra. Nếu đem hết lượng khí này cho vào dung dịch Pb(NO3)2 dư thì còn lại 2,24 lit khí. Các thể tích đều đo ở đktc.Tính % khối lượng của sắt và lưu huỳnh trong hỗn hợp đầu và tính khối lượng kết tủa tạo thành trong dung dịch Pb(NO3)2?
Cách giải:
Sắt tác dụng với lưu huỳnh, đem sản phẩm phản ứng với dung dịch HCl dư thì được khí, cho khí này vào dung dịch Pb (NO3)2 dư thì còn lại một lượng khí.
=> Hỗn hợp khí gồm: H2S và H2
Sắt tác dụng với lưu huỳnh tạo FeS và Fe dư
Fe + S –> FeS (1)
FeS + 2HCl –> FeCl2 + H2S (2)
Fedư + 2HCl –> FeCl2 + H2 (3)
H2S + Pb(NO3)2 –> PbS + 2HNO3 (4)
Theo đề: nH2 = 0.1 mol ; nhh (H2S + H2) = 0.2 mol
=> nH2S = 0.2 – 0.1 = 0.1 mol
Theo (2): nFeS = nH2S = 0.1 mol. Theo (1): nFe = nFeS = 0.1 mol ; nFe phản ứng = nFeS = 0.1 mol
Theo (3): nFe dư = nH2 = 0.1 mol
Suy ra: nFe ban đầu = 0.1 + 0.1 = 0.2 mol
=> % mFe = 77.78 % ; % mS = 22.22%
Theo (4): nPbS = nH2S = 0.1 mol
=> MPbS = 0.1 x 239 = 23.9 gam
Phương pháp giải cũng không quá phức tạp phải không nào. Teen 2k2 nên lưu ý nếu làm trắc nghiệm thì bạn chỉ nên cân bằng xong phản ứng rồi điền các số liệu ngay dưới phương trình để tính toán chứ không cần trình bày như trên.
Có 3 tuyệt chiêu này trong tay thì bạn có thể giải bài tập Hóa học lớp 10 nhanh – gọn – nhẹ. Chúc các bạn luôn đạt điểm cao trong học tập!
| Bất cứ dạng bài tập hóa lớp 10 nào thì các thầy cô của HỌC TỐT 10 luôn sẵn sàng chia sẻ cách giải tối ưu nhất cho bạn. Nếu gặp khó khăn bạn có thể xem Ở ĐÂY. |