Đề cương ôn thi học kì 1 môn Hóa 10 theo chương trình mới được HOCMAI biên soạn đầy đủ theo ba bộ sách mới gồm Kết nối tri thức, Cánh Diều, và Chân trời sáng tạo. Các em học sinh lớp 10 hãy tham khảo thật kỹ để chuẩn bị tốt nhất cho kỳ thi cuối HK1 nhé!

⇒ Tham khảo thêm:
- Đề cương ôn thi học kì 1 lớp 10 môn Lý
- Đề cương ôn thi học kì 1 lớp 10 môn Toán
- Đề cương ôn thi học kì 1 lớp 10 môn Sinh
- Đề cương ôn thi học kì 1 lớp 10 môn Tiếng Anh
A. KIẾN THỨC TRỌNG TÂM | ĐỀ CƯƠNG ÔN THI HỌC KÌ 1 MÔN HÓA 10
CHƯƠNG 1: CẤU TẠO NGUYÊN TỬ
1. Thành phần nguyên tử
a) Thành phần cấu tạo của nguyên tử
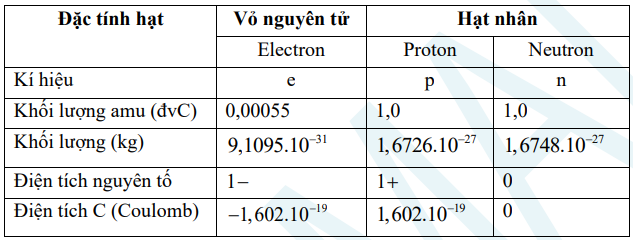
– Nguyên tử trung hòa về điện nên số proton (p) = số electron (e).
b) Kích thước và khối lượng nguyên tử
– Nguyên tử có kích thước rất nhỏ, thường dùng đơn vị nanomet (nm) hay angstrom (Å):

2. Hạt nhân nguyên tử. Nguyên tố hóa học. Đồng vị
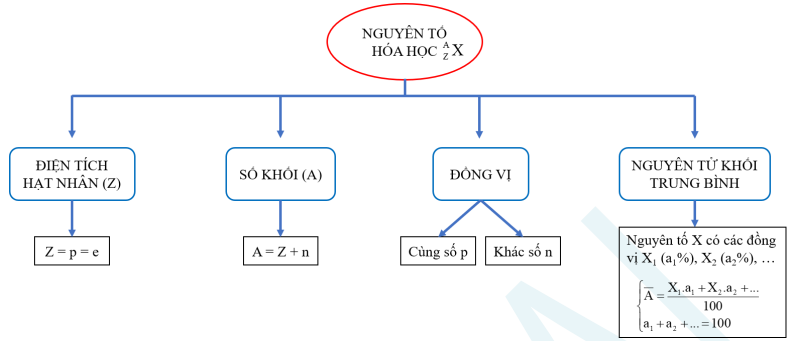
3. Cấu tạo vỏ nguyên tử
a) Sự chuyển động của electron trong nguyên tử
– Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân, không theo quỹ đạo xác định.
b) Orbital
– Là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron là lớn nhất (khoảng 90%). Kí hiệu: AO (Atomic Orbital).
– Những electron chuyển động gần hạt nhân hơn chiếm mức năng lượng thấp hơn (trạng thái bền hơn). Những electron chuyển động ở xa hạt nhân có năng lượng cao hơn.
– Dựa trên sự khác nhau về trạng thái của electron trong nguyên tử, người ta phân loại thành các orbitan s (dạng hình cầu), orbitan p (dạng hình số 8 nổi), orbitan d và orbitan f (có hình dạng phức tạp).
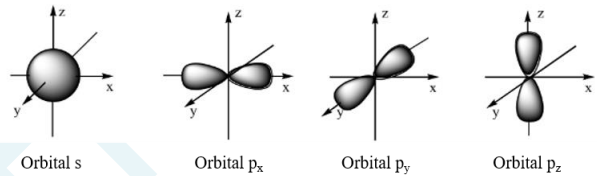
c) Lớp và phân lớp electron

4. Cấu hình electron nguyên tử
a) Mức năng lượng
– Các electron sẽ điền theo thứ tự vào các lớp có năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s…
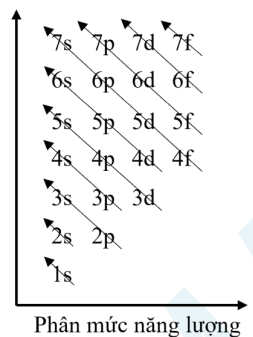
b) Cấu hình electron
Sự phân bố các electron vào orbital trong nguyên tử tuân theo các quy tắc và nguyên lí:
- Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa hai electron và có chiều tự quay ngược nhau.
- Nguyên lí vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao.
- Quy tắc Hun: Trong cùng một phân lớp, các electron sẽ phân bố trên orbital sao cho số electron độc thân là tối đa và các electron này phải có chiều tự quay giống nhau.
Cách viết cấu hình electron:
Bước 1: Xác định số electron của nguyên tử (Z).
Bước 2: Xác định thứ tự mức năng lượng: 1s 2s 2p 3s 3p 4s 3d 4p 5s …
Bước 3: Điền các electron vào các phân lớp theo thứ tự mức năng lượng (chú ý phân lớp s tối đa 2e, phân lớp p tối đa 6e, phân lớp d tối đa 10e, phân lớp f tối đa 14e).
Bước 4: Viết cấu hình electron theo thứ tự lần lượt các lớp: 1s 2s 3s 3p 3d 4s 4p 4d 5s …
c) Mối liên hệ giữa lớp electron ngoài cùng với loại nguyên tố
|
Số electron lớp ngoài cùng |
Loại nguyên tố |
Tính chất |
|
8 |
Khí hiếm | Tương đối trơ về mặt hóa học |
|
1, 2 hoặc 3 |
Kim loại (trừ H, Be và B) | Có xu hướng nhường electron, trở thành cation |
|
5, 6 hoặc 7 |
Thường là phi kim | Có xu hướng nhận electron, trở thành anion |
|
4 |
Phi kim (khi có Z nhỏ) hoặc kim loại (khi có Z lớn) |
– Nguyên tố s, p, d, f là những nguyên tố có electron cuối cùng điền vào các phân lớp s, p, d, f.
– Xu hướng của các nguyên tử là tiến tới cấu hình electron bền vững của khí hiếm gần nó nhất.
5. Một số dạng bài tập thường gặp
Dạng 1. Bài toán về các loại hạt p, n, e
Dạng 1.1. Bài toán p, n, e của nguyên tử

Dạng 1.2. Bài toán p, n, e của phân tử

Dạng 1.3. Bài toán p, n, e của ion

Dạng 2. Bài toán về khối lượng, bán kính nguyên tử
Dạng 2.1. Tính khối lượng nguyên tử

Dạng 2.2. Tính khối lượng riêng của nguyên tử

Dạng 2.3. Tính bán kính nguyên tử

Dạng 3. Bài toán về nguyên tử khối trung bình
Dạng 3.1. Tính nguyên tử khối trung bình

Dạng 3.2. Tính phần trăm số nguyên tử

35.5 = (35.1140+37.x)/(1440+x) = 380
Dạng 3.3. Tính nguyên tử khối của đồng vị

Dạng 4. Cấu hình electron
Dạng 4.1. Viết cấu hình electron nguyên tử

Dạng 4.2. Cấu hình electron của ion

CHƯƠNG 2: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
1. Bảng tuần hoàn
a) Cấu tạo bảng tuần hoàn
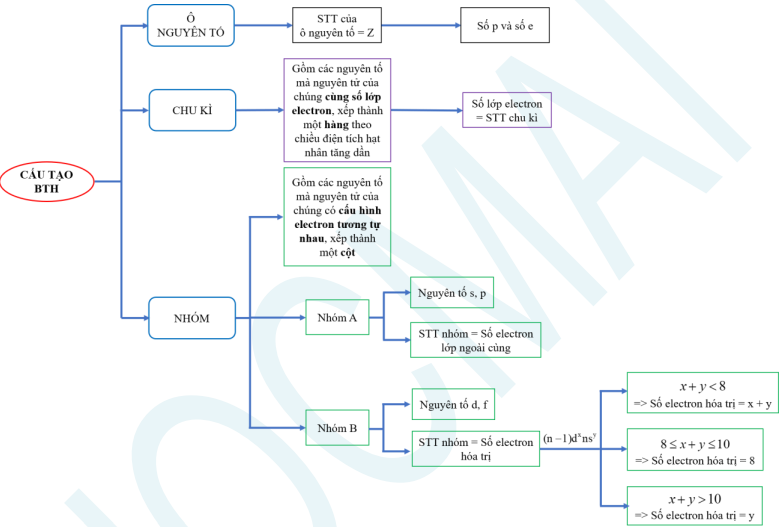
b) Nguyên tắc sắp xếp
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
- Các nguyên tố có cùng số electron hóa trị trong nguyên tử được sắp xếp thành một cột.
2. Những tính chất biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân
a) Sự biến đổi về hóa trị của các nguyên tố
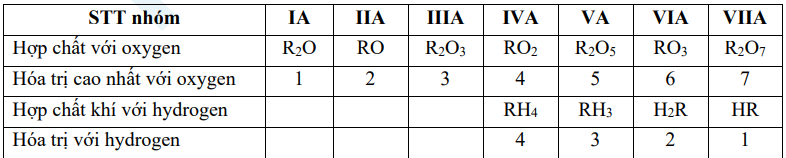
Nhận xét: Nguyên tố phi kim R có oxide cao nhất là R2O và hợp chất khí với hydrogen là RH8-n.
b) Quy luật biến thiên tính chất các nguyên tố trong bảng tuần hoàn
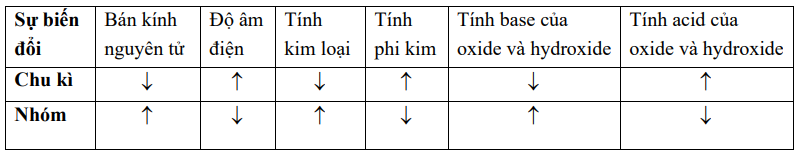
Quy ước: ↑ là tăng và ↓ là giảm.
3. Định luật tuần hoàn
a) Nội dung
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
b) Ý nghĩa
– Từ vị trí ↔ cấu tạo nguyên tử.
– Từ vị trí ↔ tính chất hóa học cơ bản.
– So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận
4. Một số dạng bài tập thường gặp
Dạng 1: Xác định chu kì, nhóm, vị trí nguyên tố
Dạng 1.1. Xác định chu kì
– Số thứ tự chu kì (số thường) = số lớp electron trong nguyên tử.

Dạng 1.2. Xác định nhóm
– Số thứ tự nhóm (số La Mã):


Dạng 1.3. Xác định vị trí nguyên tố

Dạng 2. Xác định vị trí của hai nguyên tố thuộc hai chu kì hoặc hai nhóm liên tiếp


Dạng 3. Tìm tên nguyên tố dựa vào công thức hóa học (oxide cao nhất và hợp chất với hydrogen)
– Hóa trị cao nhất của một nguyên tố trong hợp chất với oxygen = STT nhóm (STT nhóm ≤ 7).
– Hóa trị thấp nhất của một nguyên tố trong hợp chất với hydrogen = 8 – STT nhóm (STT nhóm ≥ 4). → Hóa trị thấp nhất của một nguyên tố = 8 – Hóa trị cao nhất của một nguyên tố, và ngược lại.

CHƯƠNG 3: LIÊN KẾT HÓA HỌC
1. Khái niệm liên kết hóa học
– Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
– Quy tắc bát tử (8 electron): Theo quy tắc bát tử thì nguyên tử của các nguyên tố có khuynh hướng liên kết với các nguyên tử khác để đạt được cấu hình electron vững bền của các khí hiếm với lớp ngoài cùng có 8 electron (hoặc 2 đối với heli).
2. Liên kết ion
– Khái niệm: Liên kết ion là liên kết hoá học hình thành do lực hút tĩnh điện giữa các ion trái dấu.
– Sự hình thành liên kết ion:

– Dấu hiệu nhận biết liên kết ion: Xảy ra ở các kim loại điển hình và phi kim điển hình
3. Liên kết cộng hoá trị
– Định nghĩa: Liên kết cộng hóa trị là liên kết được hình thành giữa 2 nguyên tử bằng một hay nhiều cặp electron chung.
– Mỗi cặp e chung tạo thành 1 liên kết cộng hoá trị, được biểu diễn bằng 1 gạch ngang (-).
– Phân loại liên kết cộng hoá trị:
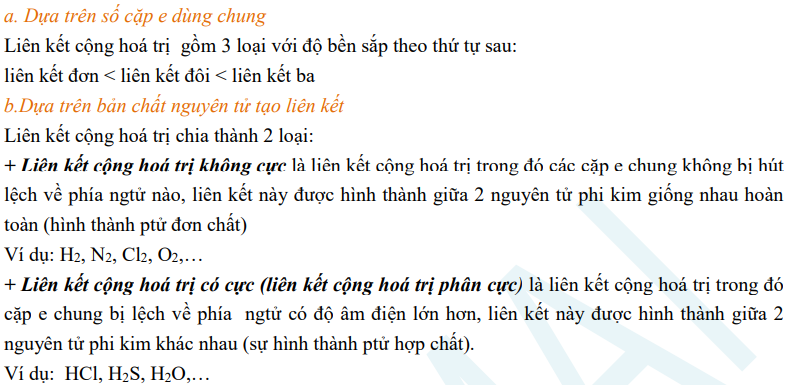
– Dấu hiệu nhận biết liên kết cộng hoá trị: Các nguyên tử giống nhau hay gần giống nhau về bản chất (thường là những nguyên tố phi kim nhóm IVA, VA, VIA, VIIA).
– Độ âm điện và liên kết hóa học:

4. So sánh liên kết ion và liên kết cộng hóa trị
– Giống nhau: Liên kết ion và liên kết cộng hoá trị alike về nguyên nhân hình thành liên kết. Các nguyên tử liên kết với nhau tạo thành phân tử để có cấu hình electron bền vững của khí hiếm.
– Khác nhau: Liên kết ion và LK cộng hoá trị khác nhau về bản chất liên kết và điều kiện liên kết:
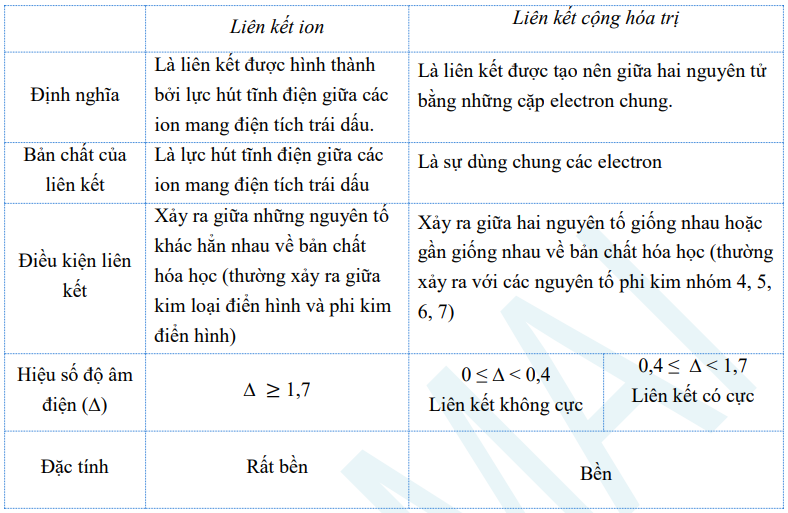
5. Hoá trị và số oxi hoá

Quy tắc 1: Số oxi hoá của các nguyên tố trong các đơn chất bằng không.
Quy tắc 2: Trong 1 phân tử, tổng số số oxi hoá của các nguyên tố bằng 0
Quy tắc 3: Số oxi hoá của các ion đơn nguyên tử bằng điện tích của ion đó. Trong ion đa nguyên tử, tổng số số oxi hoá của các nguyên tố bằng điện tích của ion.
Quy tắc 4: Trong hầu hết các hợp chất, số oxi hoá của H bằng +1 , trừ 1 số trường hợp như hidro, kim loại (NaH, CaH2 ….) . số oxi hoá của O bằng –2 trừ trường hợp OF2, peoxit (chẳng hạn H2O2,…).
6. Một số dạng bài tập thường gặp
Dạng 1: Xác định loại liên kết trong hợp chất
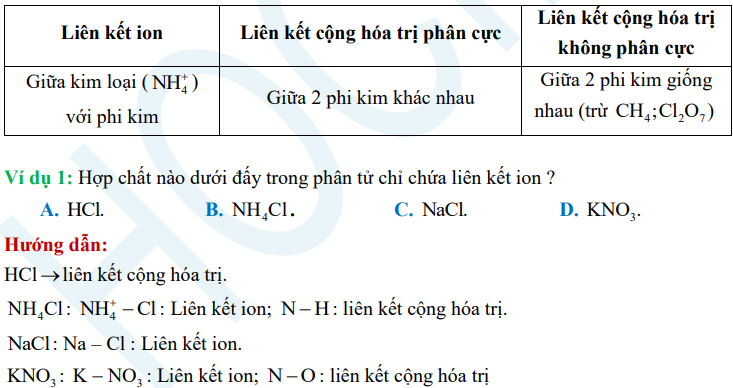
Dạng 2: Mối liên hệ giữa độ âm điện và liên kết hóa học
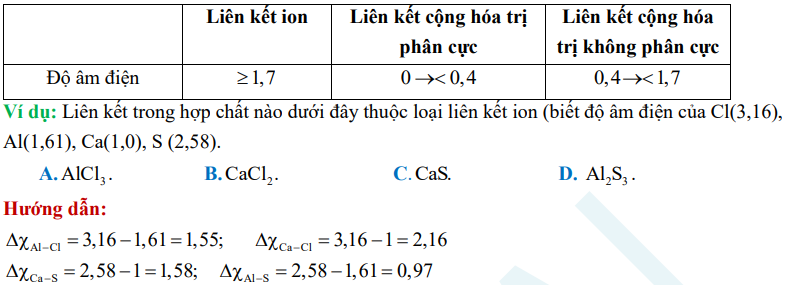
CHƯƠNG 4: PHẢN ỨNG OXI HÓA KHỬ
1. Phản ứng oxi hoá khử
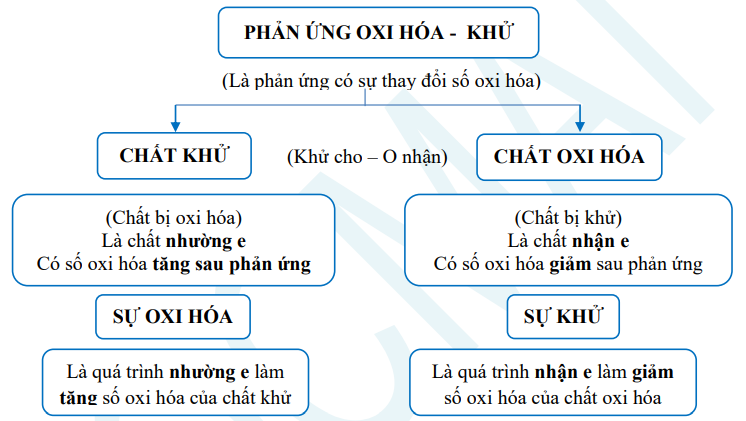
(Lưu ý: Tổng số e chất khử nhường = Tổng số e chất oxi hóa nhận)
2. Phân loại phản ứng hoá học
a) Các phản ứng thường gặp trong hóa học vô cơ


b) Phân loại phản ứng oxi hóa khử
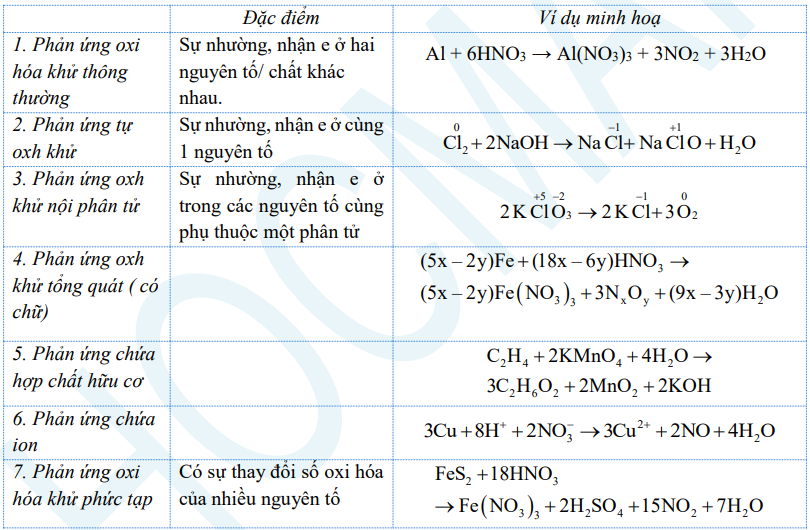
3. Một số dạng bài tập thường gặp
Dạng 1: Xác định số oxi hóa của các nguyên tố

Dạng 2: Lập phương trình phản ứng oxi hóa khử
Bước 1: Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi.
Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
Bước 3: Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron
mà chất oxi hóa nhận.
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học.
Một số loại phương trình oxi hoá khử thường gặp:
- Dạng thông thường (quá trình oxi hoá và khử ở 2 chất khác nhau trong phản ứng).
- Dạng phản ứng nội phân tử (quá trình oxi hoá và khử xảy ra trong một phân tử).
- Phản ứng tự oxi hóa khử (quá trình oxi hoá và khử xảy ra chỉ trên 1 nguyên tố).
- Phản ứng có chữ.
- Phản ứng có sự thay đổi số oxi hóa của nhiều hơn hai nguyên tử.
- Phản ứng oxi hóa khử có chứa hợp chất hữu cơ.
Dạng 3: Bài tập áp dụng định luật bảo toàn electron

II – ĐỀ ÔN THI HỌC KÌ 1 MÔN HÓA 10 THEO CHƯƠNG TRÌNH MỚI
Sau khi ôn luyện lại toàn bộ kiến thức lý thuyết đã học trong chương trình Hóa Học lớp 10, các em hãy luyện tập với các đề thi để nắm chắc cũng như làm quen với ma trận đề thi. HOCMAI đã tổng hợp đầy đủ 3 bộ đề thi cuối học kì 1 môn Hóa lớp 10 đầy đủ theo 3 bộ sách mới là Cánh Diều, Kết nối tri thức với cuộc sống và Chân trời sáng tạo. Các em học sinh tham khảo ngay tại đây:
Tham khảo Đề thi học kì 1 Hóa 10 Cánh Diều (Có hướng dẫn giải chi tiết) tại đây:
Tham khảo Đề thi học kì 1 Hóa 10 Kết nối tri thức (Có hướng dẫn giải chi tiết) tại đây:
Tham khảo Đề thi học kì 1 Hóa 10 Chân trời sáng tạo (Có hướng dẫn giải chi tiết) tại đây:
Trên đây là chi tiết về Đề cương ôn thi học kì 1 môn Hóa 10 theo chương trình mới do HOCMAI biên soạn. Hy vọng với những kiến thức được tổng hợp cũng như các bộ đề thi ôn luyện cuối HK1 trong bài, các em học sinh sẽ nắm chắc kiến thức để đạt được kết quả cao khi tham gia kỳ thi chính thức.


























